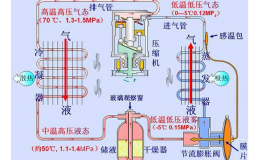
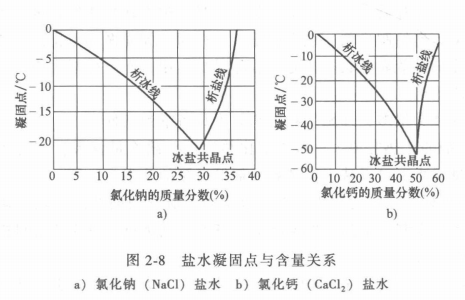
盐水的性质与溶液中的盐量多少有关。盐水的凝固点取决于盐水的含量,图2-8中的a和b图分别表示氯化钠盐水和氯化钙盐水的凝固点与含量关系。图线中左边曲线表示出随盐水的含量增加,盐水的凝固点就降低,一直到冰盐共晶点为止,此点相当于全部盐水冻结成一块冰盐结晶体,冰盐共晶点是最低的冰点,如果盐水的含量不变,而温度降低.低于该含盆所对应的冰点时,则有冰从盐水中析出,所以共晶点左面的曲线就是析冰线。由此可见,当盐水含量一定时,其凝固点的温度也是一定的,在一定范围内,含量增加,冰点降低。当含量超过共晶点时,就会有结晶盐从盐溶液中析出而冰点升高,所以冰盐共晶点右面的曲线又称析盐线。不同的盐水溶液共晶点是不同的,如氯化钠盐水,质量分数为23.1%时,共晶点温度为-21.2℃;氯化钙盐水,质量分数为29.9%时,其共晶点温度为-55℃。所以我们在选择盐水溶液时,盐的含量一定要适中。过大和过小都是不利的。一般情况是使盐水凝固点比系统中制冷剂蒸发温度低4~8℃。
氯化钠等盐水溶液最大的缺点是对金属有强烈的腐蚀作用。实践证明,金属被腐蚀与盐水溶液中的含氧量有关,含氧量越大,腐蚀性越强。盐水中的氧主要来自空气,为了减少含氧量最好采用封闭式盐水系统,减少与空气接触。此外,可向盐水中加一定量的缓蚀剂,一般采用氢氧化钠(NaOH)和重铬酸钠(Na2Cr2O7),溶液呈碱性反应(pH值≈8.5),可用酚酞试剂测试。注意重铬酸钠有毒,能使皮肤破裂,有腐蚀作用,调配溶液时应小心。
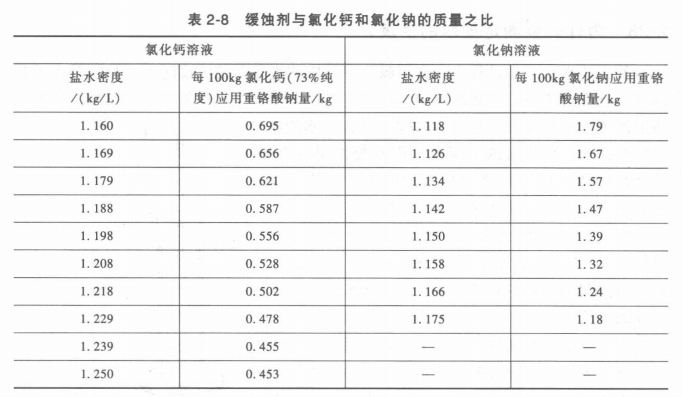
盐水中加缓蚀剂最适宜的添加量为:
1m³氯化钠盐水溶液应加入NaOH 0. 87kg, Na2Cr2O7 3. 2kg,1m³氯化钙盐水溶液应加入NaOH 0. 32kg, Na2Cr2O7 1.6kg,重铬酸钠与氢氧化钠的质量之比应为100:27,即每100kg重铬酸钠需加入27kg氢氧化钠。
缓蚀剂与氯化钙和氯化钠的质量之比见表2-8。